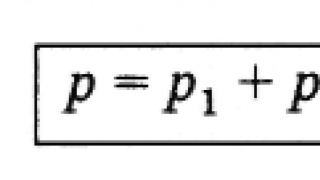Следует сказать еще о двух газовых законах. Один из них касается числа молекул различных газов при одинаковых давлениях и температурах, а другой относится к смеси газов.
Закон Авогадро
В начале XIX в. было установлено правило кратных отношений для газов, вступающих в химическую реакцию. Если температуры и давления газов, соединяющихся друг с другом, равны, то их объемы находятся в простых отношениях: 1:1, 1:2, 1: 3 и т. д. На основании этого правила Авогадро в 1811 г. высказал смелую для того времени гипотезу: в равных объемах газов при одинаковых температурах и давлениях содержится одинаковое число молекул. При отношении 1: 1 молекулы реагирующих газов соединяются попарно. Если отношение объемов равно 1: 2, то каждая молекула первого газа присоединяет к себе две молекулы второго и т. д.
В настоящее время гипотеза Авогадро строго доказана и носит название закона Авогадро.
Согласно закону Авогадро различные газы, взятые в количестве 1 моль, имеют одинаковые объемы при одинаковых давлениях р и температурах t , так как число молекул в них одно и то же. При нормальных условиях, т. е. при температуре О °С и атмосферном давлении 101 325 Па, этот объем, как показывают измерения, равен
Объем V M 0 называют молярным.
Почему же в равных объемах газов при одинаковых давлениях и температурах всегда обнаруживается одно и то же число молекул независимо от того, какой газ взят? Объяснить это можно только с помощью молекулярно-кинетической энергии (см. §4.5).
Закон Дальтона
Чаще имеют дело не с чистым газом - кислородом, водородом и т. д., а со смесью газов. Атмосферный воздух, в частности, представляет собой смесь азота, кислорода и многих других газов. Каждый из газов смеси вносит свой «вклад» в суммарное давление на стенки сосуда. Давление, которое имел бы каждый из газов, составляющих смесь, если удалить из сосуда остальные газы, называют парциальным (т. е. частным) давлением.
Простейшее предположение, которое можно сделать, состоит в том, что давление смеси газов р равно сумме парциальных давлений всех газов р 1 , р 2 , р 3 ...:
 (3.8.2)
(3.8.2)
Английский химик Д. Дальтон установил, что для достаточно разреженных газов именно так и есть в действительности. Соотношение (3.8.2) называют законом Дальтона.
С точки зрения молекулярно-кинетической теории закон Дальтона выполняется потому, что взаимодействие между молекулами идеального газа пренебрежимо мало. Поэтому каждый газ оказывает на стенку сосуда такое давление, как если бы остальных газов не было.
Моль любого газа при нормальных условиях занимает объем 22,4 л. Это значение объема установлено экспериментально. В смеси газов каждый из них оказывает давление на стенки сосуда независимо от присутствия других газов.
§ 3.9. Уравнение состояния идеального газа
Состояние данной массы газа характеризуется тремя макроскопическими параметрами: давлением р, объемом V и температурой Т. Сейчас мы найдем связь между ними.
Уравнение состояния
В § 3.5 и 3.6 вы ознакомились с поведением идеального газа в специально созданных условиях. Два параметра из трех (р, V или V , Т) изменялись при постоянном значении третьего (Г или р). Обычно же в природе и технике у газа меняются сразу все три параметра. Например, когда нагретый у поверхности Земли воздух поднимается вверх, то он расширяется, давление его уменьшается и температура понижается.
Используя газовые законы (3.5.2) и (3.7.8), можно получить уравнение, связывающее все три параметра p , V и T , характеризующие состояние газа данной массы. Это уравнение называют уравнением состояния идеального газа.
Формулировка: общее давление смеси и газов равно сумме парциальных давлений газов, составляющих эту смесь.
Парциальное давление газа - это такое давление, которое бы оказывал газ, если бы он в системы был один и занимал весь тот объем, который занимает система.
- 44 г - 6,02*
- 4 г - х
- 4= 66,22*
Задача. На сжигание 2 г металла потребляется 400 мл кислорода. Найти эквивалент металла.
Задача. Относительная плотность по водороду равна 14. Рассчитать молярную массу.
М=28 г/моль
Химическая термодинамика
Химическая термодинамика- это раздел курса физической химии, в котором изучаются процессы теплообмена между системой и окружающей средой, а также свойства системы, находящейся в равновесии.
Основные понятии.
Система- это материальная часть Вселенной, которая подвергается теоретическому и экспериментальному изучению.
Границы раздела между системой и окружающей средой может носить как реальный, так и фиктивный (мнимый) характер.
Если система обменивается с окружающей средой веществом и энергией, то такая система называется открытой.
Если система не обменивается с окружающей средой веществом и энергией, то такая система называется изолированной.
Если обменивается энергией и не обменивается веществом, то называется закрытой.
Экзотермическая реакция- реакция, проходящая с поглощением теплоты.
Эндотермическая реакция- реакция, проходящая с выделением теплоты.
Функция состояния F (p,V,T…) называется функция состояния, если ее значение не зависит от пути перехода системы из одного состояния в другого, а зависит только от значения параметров в начальном и конечном состоянии.
- 1. Потенциальная энергия (т.к. ее значение зависит только от разности высот и не зависит от пути перехода)
- 2. pV
- 3. Внутренняя энергия системы.
Система находится в состоянии термодинамического равновесия, если одновременно осуществляется механизм равновесия (давление во всех точка системы одинаково), термодинамическое и химическое равновесие (это состав исходных веществ и продуктов реакции во всех точках одинаково).
Обратимым называется такой процесс, при котором система переходит из одного состояния в другое через непрерывный ряд равновесных процессов. При этом параметры системы и окружающей среды отличаются друг от друга на бесконечно малую величину. В противном случае процесс называется необратимым.
Гомогенной называется система, в которой компоненты находятся в одной фазе. Гетерогенной называется система, в которой компоненты находятся в разной фазе. Рассмотрим является ли теплота и работа функциями состояния. И работа, и теплота- это форма передачи энергии. Работа в виде упорядоченного движения частиц, теплота - в хаотическом.
Рассмотрим процесс расширения идеального газа при t=const
1. Процесс обратимый
d- бесконечно малая из функции состояния
p внутр= p вн
2. Процесс необратимый
Таким образом, величина механической работы не является функцией состояния. Зависит от пути перехода процесса из одного состояния в другое и поэтому ее малое изменение теплоты будет обозначать.
I закон термодинамики.
Формулировка: внутренняя энергия системы является функцией состояния, это значит что не важно по какому пути идет процесс.
Рассмотрим частные случаи.
1. При р=const
Энтальпия
Физический смысл энтальпий - это тепловой эффект реакции при р=const.
2. При V=const
Физический смысл - тепловой эффект реакции при V=const
Термохимия. Закон Гесса.
Тепловой эффект реакции обусловлен тем, что энергия продуктов отличается от энергии реагентов.
Выделение тепла (реакция экзотермическая)
Поглощение тепла (реакция эндотермическая)
Если реакция проходит через ряд промежуточных состояний, то тепловой эффект реакции не зависит от пути перехода системы из одного состояния в другое, а зависит только от значения параметров системы в конечном и начальном состояниях.
I следствие закона Гесса: тепловой эффект реакции равен разности сумм теплот образования продуктов и реагентов с учетом стехиометрических коэффициентов, стоящих в уравнении реакции.
nj, ni- стехиометрические коэффициенты - теплота образования
Тепловое эффект реакции - образование 1 моль сложного вещества из простых.
o - стандартное состояние
Все теплоты образования измеряются для стандартного состояния (298К, Па, для жидкостей с концентрацией 1 моль в 1 литре, для твердых веществ выбирается наиболее устойчивая кристаллографическая модификация)
В термохимии теплоты образования простых веществ условно принимаем равных нулю.
I следствие закона Гесса: тепловой эффект реакции равен разности сумм теплот сгорания реагентов и продуктов с учетом стехиометрических коэффициентов, стоящих в уравнении реакции.
Теплота сгорания - тепловой эффект реакции полного сгорания одного моля вещества в токе калориметра при атмосферном давлении.
Задача. Определить теплоту сгорания
(кДж/моль) : -873,79 -1966,91 2254,21 0
= (-873,79-1566,97)-(-2254,81)=13,51- экзотермическая реакция, т.е. на 1 моль уксусной кислоты выделяется 13,51 тепла.
Зависимость теплового эффекта реакции от температуры. Уравнение Кирхгофа.
Теплоемкости
то тепло, которое нужно сообщить 1 моль вещества, чтобы нагреть на.
Для того чтобы рассчитать тепловой эффект реакции при температуре, нужно рассчитать тепловой эффект при 298К изменения теплоемкости денной реакции (разность сумм тепловых эффектов продуктов и реагентов с учетом стехиометрических коэффициентов)
Несмотря на то, что теплоемкость зависит от температуры, для расчетов будем считать, что теплоемкость не зависит от температуры и температуру будем брать 298 К.
II закон термодинамики. Существует функция состояния S называется энтропией. dS-полный дифференциал, который в обратимых процессах равен
dS = , в необратимых - dS . =
Для изолированных систем теплообмена с окружающей средой не происходит, поэтому для обратимых процессов, для необратимых.
Для изолированных систем самопроизвольно протекающих процессов (необратимые процессы) идут с возрастанием энтропии.
Если система находится в термодинамическом состоянии 1, которое соответствует числу микросостояний, то система переходит в термодинамическое состояние 2, если ему соответствует большее число микросостояний
Физический смысл энтропии - мера молекулярного беспорядка.
Чем больше хаотичность, те больше S.
Для расчета изменения энтропии в ходе реакции надо знать всех участвующих в реакции.
Стандартные значения энтропий всех веществ при 298 К приводятся в справочнике термодинамических величин.
III закон термодинамики.
Энтропия идеального кристалла при температуре абсолютного 0 по Кельвину равна S=0.
Идеальный кристалл - кристалл, в котором атомы занимают все узлы кристаллической решетки в строгом соответствии с геометрическими законами. При 0 К в таком кристалле полностью отсутствует колебательное, вращательное, поступательное движение частиц, т.е., одно единственное микросостояние описывается одним единственным макросостоянием.
Расчет изменения энтропии при нагревании.
Процессы фазовых переходов являются изобарно-изотермическими и обратимыми, поэмому изменение энтропии для обратимого процесса равно отношению теплоты образования продукта к температуре.
Энергия Гиббса.
Изменение энергии Гиббса как критерий самопроизвольного течения процесса в закрытых системах.
Обратимый процесс Необратимый процесс
DG- изотермический потенциал
- ?S=?U/T
- ?H-T?S=0 P,T=const
- ?S_ >?H/T
DG=DH-TDS < 0
(энергия Гиббса)
- ?S>?U/T
- ?H-T?S
Изохорно-изотермический потенциал
Состояние равновесия
Физический смысл изменения энергии Гиббса: максимально полезная работа, которая совершает система.
Если есть фазовый переход
Физический смысл: если энтальпия характеризует стремление системы к упорядоченности (т.е. к понижению запаса энергии), то энтропия характеризует стремление системы к хаотичности, а энергий Гиббса является результатирующей величиной этих противоположно направленных процессов.
Химическое равновесие.
Термодинамика дает возможность определить не только направление процесса (по знаку энергии Гиббса), но и количественного расчета системы в состоянии равновесия.
Рассмотрим гомогенную газообразную реакцию
константа равновесия
Константа равновесия равна отношению парциальных давлений продуктов к парциальным давлениям исходных веществ в степенях равных их стехиометрическим коэффициентам.
Условия смещения химического равновесия (принцип Ле Шателье)
Формулировка: если на систему, находящуюся в равновесии, извне действует сила, то равновесие смещается в том направлении, которое ослабляет приложенное воздействие.
I. Влияние температуры на смещение равновесия (изобара Вант-Гоффа)
Повышение температуры способствует протеканию той реакции, которая уменьшает положенное тепло, смещает равновесие в сторону изотермической реакции.
Чем больше, тем больше температура влияет на смещение равновесия.
II. Влияние давления на смещение равновесия.
равновесие
Давление газообразных систем обусловлено числом ударений молекул о стенки сосуда.
При увеличении давления равновесие смещается в сторону тех веществ, которые занимают меньший объем (в сторону уменьшения числа молекул).
III. Влияние состава.
Увеличение концентрации одного из реагентов способствует смещению равновесия в сторону образования продуктов реакции.
Основным уравнением для расчета химического равновесия по таблице термодинамических величин является
(все вещества газы) при Т = 600К.
(кДж) (Дж/моль)
7,22 Дж/моль К
При подстановке получим:
Ответ: - 84%
Чем больше отрицательная энергия Гиббса, тем больше значение константы равновесия, следовательно, в равновесной системе будут преобладать продукты реакции.
Если константа равновесия меньше 1, то энергия Гиббса больше 0.
Химическая кинетика.
Химическая кинетика - это раздел физической химии, которая изучает протекание процессов во времени.
Средняя скорость - изменение концентрации реагентов или продуктов за определенный промежуток времени.
Истинная (мгновенная) скорость
Cкорость реакции всегда величина положительная, а знак зависит от того, какую концентрацию берет, исходных веществ или продуктов («-» -исходные вещества, «+»- продукты). Тангенс угла наклона касательной к кривой позволяет рассчитать истинную скорость в каждый момент времени.
Для гетерогенных реакций:
S-поверхность раздела масс.
Закон действующих масс.
Закон действующих масс - это основной закон формальной кинетики.
Рассмотрим гомогенную реакцию, где все вещества в газообразных состояниях. Формулировка закона: скорость реакции прямо пропорциональна концентрации реагирующих веществ в степенях, равных стехиометрическим коэффициентам.
Физический смысл константы скорости - скорость реакции, если концентрация равна 1.
Задача. Как изменится скорость прямой реакции, если давление увеличить в 3 раза.
Если давление увеличивается в 3 раза, то и концентрация увеличивается в 3 раза (уравнение Менделеева-Клайперона)
Ответ: увеличится в 27 раз
Для гетерогенных реакций скорость зависит только от концентрации газообразных веществ, т.к. у твердых веществ она есть величина постоянная.
Порядок реакции обозначается n, определяется суммой показателей степеней в законе действующих масс. Для элементарных реакций, которые протекают в одну стадию, порядок и молекулярность совпадают, для сложных - не совпадает.
Изучение порядка реакции является методом изучения ее механизма.
1) Кинетическое уравнение I порядка (все реакции распада)
Пусть в начальный момент времени концентрация - а молей/литр. Если в момент времени
Х молей вещества а, то
Таким образом, для реакции I порядка графиком в координатах InC() является прямая с отрицательным наклоном, и tg позволяет рассчитать константу скорости
2) Кинетическое уравнение реакции II порядка
Считаем, что первоначальная концентрация веществ равна.
Если в момент времени прореагировало а молей/литр, то
3) Кинетическое уравнение реакции III порядка Если нив одном из случаев InC , прямая не получилась, то механизм реакции является сложным, т.е. реакции протекает в несколько стадий. Общая скорость всей реакции равна сумме скоростей всех стадий.
Второй характеристикой реакции I порядка является период полураспада
Влияние температуры на скорость реакции. Уравнение Вант-Гоффа.
При повышении температуры на каждые 1С скорость реакции возрастает на 2-4 раза.
правило Вант - Гоффа
Теория Аррениуса.
Основные положения:
- 1) Чтобы произошло химическое взаимодействие веществ, должно произойти их столкновение
- 2) Энергия частиц должна быть больше или равна энергии активации реакции
- 3) Столкновения частиц должно происходить на функциональную группу
Энергия активации - эта та минимальная энергия, которую нужно сообщить молекуле, чтобы произошло химическое взаимодействие.
С ростом температуры энергия активации растет.
где K- константа скорости, А- предэкспотенциальный множитель, R-универсальная газовая постоянная, Т-температура в Кельвинах.
1) Аналитический
Разделим (1) уравнение на (2)
Если известны значения двух констант скоростей при двух температурах, то можно рассчитать величину энергии активации реакции.
2) Графический
Недостатки теории Аррениуса:
- 1) Реальная скорость часто оказывается ниже, чем рассчитанная по теореме Аррениуса
- 2) теория не объясняет явление катализа.
Некоторая реакция протекает за 16 мин при температуре 2 За сколько эта реакция будет протекать при температуре 5, если =3.
На практике чаще встречаются не чистые газы, а их смеси. Компоненты смеси занимают один и тот же объем и имеют одинаковую температуру. Концентрация смеси равна сумме концентраций компонентов смеси, т. е.
Тогда по формуле (4.5) давление смеси равно:
Введем обозначения:
где ![]() - парциальные давления.
- парциальные давления.
В общем случае для описания движения микрочастиц, необходимо применять законы квантовой механики . Статистическая физика, описывающая макросистемы, состоящие из микрочастиц, движение которых описывается законами квантовой механики, называется квантовой статистикой .
Одним из основных понятий статистики (как классической, так и квантовой) является вероятность . Пусть какая-либо физическая система может находиться в различных физических состояниях. Предположим, что эти состояния дискретны, т.е. характеризующие их физические величины изменяются скачками и каждое состояние характеризуется определенным значением х i некоторой физической величины х.
В некоторых состояниях система будет проводить большее время, в некоторых - меньшее. Будем измерять величину х некоторое число раз N. Обозначим N i - число измерений, каждое из которых дает значение измеряемой величины х, равное х i . Вероятность w i того, что величина х имеет значение х i , называется предел отношения числа N i к полному числу измерений N при стремлении N к бесконечности, т.е.:
 (1.16)
(1.16)
Дискретное значение физических величин - характерная особенность всех микрочастиц (атомов, молекул). Например, энергия вращательного и колебательного движения молекулы может меняться только дискретно, скачками. Про такую величину говорят, что она квантуется.
Вместе с тем, можно с большой точностью считать, что энергия поступательного движения молекул не квантуется, т.е. изменяется непрерывно, значит, непрерывно меняется и скорость молекул газа, а также и координата молекул в пространстве. Для непрерывной случайной величины, например, скорости молекулы v, вероятность dw v того, что скорость молекулы v принимает значения в интервале от v до v + dv вычисляется так:
 (1.17)
(1.17)
здесь N - полное число измерений скорости, dN v - число измерений, в которых скорость молекулы попали в интервал от v до v + dv.
Очевидно, что:
Это следует из определения вероятности (1.17):
Аналогично и для непрерывной случайной величины. Из (1.18) следует, что:
 (1.19)
(1.19)
Барометрическая формула
Барометрическая формула дает зависимость давления р идеального газа, находящегося в однородном поле тяжести при постоянной температуре Т, от высоты z:
 (1.20)
(1.20)
где p o - давление при z = 0, m o - масса молекулы, k - постоянная Больцмана .
Распределение Больцмана.
Максвеллом было получено следующее соотношение:
 (1.23)
(1.23)
здесь - вероятность обнаружения молекулы в бесконечно малом прямоугольном параллелепипеде в пространстве скоростей, изображенном на рис. 1.3.

Другими словами, это вероятность того, что молекула имеет проекцию скорости на ось х в интервале от v х до v х + dv х и в подобных же интервалах для значений v y и v z .
Из (1.23) видно, что вероятность не зависит от направления вектора , а зависит только от его модуля. Поэтому в формуле (1.23) в качестве элементарного объема в пространстве скоростей вместо прямоугольного параллелепипеда можно взять бесконечно тонкий сферический слой (см. рис. 1.4), радиус которого v, а толщина dv. В этом элементарном объеме все модули скоростей с отклонением, не превышающем dv, равны v. Перейдем, таким образом, от dv х, dv y ,dv z к 4πv 2 dv, где 4πv 2 - площадь сферы в пространстве скоростей, изображенной на рис. 1.4.

После чего формула (1.23) принимает вид:
 (1.24)
(1.24)
Формулу (1.24) обычно записывают в виде:
![]() (1.25)
(1.25)
где  (1.26)
(1.26)
Полученную Д.К. Максвеллом функцию F(v) принято называть функцией распределения вероятностей или функцией распределения Максвелла.
Из (1.25) следует, что:
![]()
поэтому F(v) называют еще и плотностью вероятности.
График функции распределения Максвелла приведен на рис. 1.5.

Парциальное давление каждого газа, входящего в состав смеси, это давление, которое создавалось бы той же массой данного газа, если он будет занимать весь объем смеси при той же температуре.
В природе и в технике мы очень часто имеем дело не только с одним чистым газом, но со смесью нескольких газов. Например воздух, это смесь азота, кислорода, аргона, углекислого газа и других газов. От чего зависит давление смеси газов?
В 1801 г. Джон Дальтон установил, что давление смеси нескольких газов равно сумме парциальных давлений всех газов, составляющих смесь .
Этот закон получил название закона парциальных давлений газов
Закон Дальтона Парциальное давление каждого газа, входящего в состав смеси, это давление, которое создавалось бы той же массой данного газа, если он будет занимать весь объем смеси при той же температуре.
Закон Дальтона устанавливает, что давление смеси (идеальных) газов составляет сумму парциальных давлений компонент смеси (парциальное давление компоненты – это давление, которое компонента оказала бы, если бы она одна занимала все пространство, занятое смесью). Этот закон указывает, что на каждую компоненту не воздействует присутствие других компонент и свойства компоненты в смеси не меняются.
Два закона Дальтона
Закон 1 Давление смеси газов равно сумме их парциальных давлений. Из этого следует, что парциальное давление компонента газовой смеси равно произведению давления смеси на молярную долю этого компонента.
Закон 2 Растворимость компонента газовой смеси в данной жидкости при постоянной температуре пропорциональна парциальному давлению этого компонента и не зависит от давления смеси и природы других компонентов.
Законы сформулированы Дж. Дальтоном соотв. в 1801 и 1803.
Уравнение закона Дальтона
Как уже отмечалось, отдельные компоненты смеси газов считаются независимыми. Поэтому каждая компонента создает давление:
\[ p = p_i k T \quad \left(1\right), \]
а полное давление равно сумме давлений компонент:
\[ p = p_{01} k T + p_{02} k T + \cdots + p_{i} k T = p_{01} + p_{02} + \cdots + p_{i} \quad \left(2\right),\]
где \(p_i \) - парциальное давление i газовой компоненты. Это уравнение - закон Дальтона.
При больших концентрациях, больших давлениях закон Дальтона не выполняется в точности. Так как проявляется взаимодействие между компонентами смеси. Компоненты перестают быть независимыми. Дальтон объяснил свой закон с помощью атомистической гипотезы.
Пусть имеется i компонент в смеси газов, тогда уравнение Менделеева - Клайперона будет иметь вид:
\[ {(p}_1+p_2+\dots +p_i)V=(\frac{m_1}{{\mu }_1}+\frac{m_2}{{\mu }_2}+\dots +\frac{m_i}{{\mu }_i})RT\ \quad \left(3\right), \]
где \(m_i \) - массы компонент смеси газа, \({\mu }_i \) - молярные массы компонент смеси газа.
Если ввести \(\left\langle \mu \right\rangle \) такую, что:
\[ \frac{1}{\left\langle \mu \right\rangle }=\frac{1}{m}\left[\frac{m_1}{{\mu }_1}+\frac{m_2}{{\mu }_2}+\dots +\frac{m_i}{{\mu }_i}\right] \quad \left(4\right), \]
то уравнение (3) запишем в виде:
\[ pV=\frac{m}{\left\langle \mu \right\rangle }RT \quad \left(5\right). \]
Закон Дальтона можно записать в виде:
\[ p=\sum\limits^N_{i=1}{p_i}=\frac{RT}{V}\sum\limits^N_{i=1}{{\nu }_i}\ \quad \left(6\right). \]
\[ p_i=x_ip\ \quad \left(7\right), \]
где \(x_i-молярная\ концентрация\ i-го \) газа в смеси, при этом:
\[ x_i=\frac{{\nu }_i}{\sum\limits^N_{i=1}{н_i}}\ \quad \left(8\right), \]
где \({\nu }_i \) - количество молей \(i-го \) газа в смеси.
В вашем браузере отключен Javascript.Чтобы произвести расчеты, необходимо разрешить элементы ActiveX!
Газовая смесь находится в состоянии равновесия, если концентрации компонентов и её параметры состояния во всём объёме имеют одинаковые значения. При этом температура всех газов, входящих в смесь, одинакова и равна температуре смеси Т см.
В равновесном состоянии молекулы каждого газа рассеяны равномерно по всему объёму смеси, то есть имеют свою определённую концентрацию и, следовательно, своё давление р i , Па, которое называется парциальным . Оно определяется следующим образом.
Парциальное давление равно давлению данного компонента при условии, что он один занимает весь объём, предназначенный для смеси при температуре смеси Т см .
По закону английского химика и физика Дальтона, сформулированному в 1801 году, давление смеси идеальных газов р см равно сумме парциальных давлений её компонентов р i :
где n – число компонентов.
Выражение (2) также называется законом парциальных давлений.
3.3. Приведённый объём компонента газовой смеси. Закон Амага
По определению приведённым объёмом i -го компонента газовой смеси V i , м 3 , называется объём, который один этот компонент мог бы занимать при условии, что его давление и температура будут равны давлению и температуре всей газовой смеси.
Закон французского физика Амага, сформулированный примерно в 1870 году, гласит: сумма приведённых объёмов всех компонентов смеси равна объёму смеси V см :
 ,
м 3 . (3)
,
м 3 . (3)
3.4. Химический состав газовой смеси
Химический состав газовой смеси может задаваться тремя различными способами.
Рассмотрим газовую смесь, состоящую из n компонентов. Смесь занимает объём V см, м 3 , имеет массу М см, кг, давление р см, Па и температуру Т см, К. Также число молей смеси равно N см, моль. При этом масса одного i -го компонента m i , кг, а число молей этого компонента ν i , моль.
Очевидно, что:
 , (4)
, (4)
 . (5)
. (5)
Используя для рассматриваемой смеси закон Дальтона (2) и Амага (3) можно записать:
 , (6)
, (6)
 , (7)
, (7)
где р i – парциальное давление i -го компонента, Па; V i – приведённый объём i -го компонента, м 3 .
Однозначно химический состав газовой смеси может быть задан либо массовыми, либо мольными, либо объёмными долями её компонентов:
 , (8)
, (8)
 , (9)
, (9)
 , (10)
, (10)
где g i , k i и r i – массовая, мольная и объёмная доли i -го компонента смеси соответственно (безразмерные величины).
Очевидно, что:
 ,
,
 ,
, . (11)
. (11)
Часто на практике химический состав смеси задаётся не долями i -го компонента, а его процентами.
Например, в теплотехнике приближённо принимается, что сухой воздух состоит из 79 объёмных процентов азота и 21 объёмного процента кислорода.
Процент i -го компонента в смеси вычисляется путём умножения его доли на 100.
Для примера с сухим воздухом будем иметь:
 ,
,
 . (12)
. (12)
где
 и
и
 –
объёмные доли азота и кислорода в сухом
воздухе; N 2
и О 2
– обозначение объёмных процентов азота
и кислорода соответственно, % (об.).
–
объёмные доли азота и кислорода в сухом
воздухе; N 2
и О 2
– обозначение объёмных процентов азота
и кислорода соответственно, % (об.).
Примечание:
1) Мольные доли идеальной смеси численно равны объёмным долям: k i = r i . Докажем это.
Пользуясь определением объёмной доли (10) и законом Амага (3) можем записать:
 ,
(13)
,
(13)
где
V
i
– приведённый объём
i
-го
компонента, м
3
;
ν
i
– число молей
i
-го
компонента, моль;
 –
объём одного моля
i
-го
компонента при давлении смеси р
см
и температуре
смеси Т
см ,
м
3
/моль.
–
объём одного моля
i
-го
компонента при давлении смеси р
см
и температуре
смеси Т
см ,
м
3
/моль.
Из закона Авогадро (см. п. 2.3 данного приложения) следует, что при одинаковых температуре и давлении один моль любого газа (компонента смеси) занимает один и тот же объём. В частности, при Т см и р см это будет некоторый объём V 1 , м 3 .
Сказанное позволяет записать равенство:
 .
(14)
.
(14)
Подставляя (14) в (13) получаем требуемое:
 .
(15)
.
(15)
2) Объёмные доли компонентов газовой смеси можно рассчитать, зная их парциальные давления. Покажем это.
Рассмотрим i -ый компонент идеальной газовой смеси в двух различных состояниях: когда он находится при своём парциальном давлении р i ; когда он занимает свой приведённый объём V i .
Уравнение состояния идеального газа справедливо для любых его состояний, в частности, и для двух, названных выше.
В соответствии с этим, и учитывая определение удельного объёма, можем записать:
 ,
(16)
,
(16)
 ,
(17)
,
(17)
где R i – газовая постоянная i -го компонента смеси, Дж/(кг·К).
После деления обоих частей (16) и (17) друг на друга получаем требуемое:
 .
(18)
.
(18)
Из (18) видно, что парциальные давления компонентов смеси можно рассчитать по её химическому составу, при известном общем давлении смеси р см :
 .
(19)
.
(19)